浅谈元素化学
第十一章 钠和钠的化合物
一、金属钠
1. 物理性质
- 色、味、态:常温常压下,钠为具有银白色光泽的固体(大多数金属有金属光泽,除 \(\ce{Cu}\) 紫红色,\(\ce{Au}\) 金色;大多数金属粉末为黑色,除 \(\ce{Mg}\)、\(\ce{Al}\) 粉银白色,\(\ce{Cu}\) 粉红色)
- 熔沸点:钠的熔点比较低,为 \(97.8℃\)
- 密度:固态密度介于水和煤油之间(故 \(\ce{Na}\) 存放在水中)
- 其他性质:钠质软,可以用小刀切割
2. 化学性质
- 与水反应显碱性
\[\ce{2Na + 2H2O \xlongequal{\quad} 2NaOH + H2 ^}\]
- 现象
- 浮:\(\ce{Na}\) 密度小于水,浮在水面上
- 熔:反应放热,\(\ce{Na}\) 熔点低,形成小球
- 游:生成 \(\ce{H2}\),推动 \(\ce{Na}\) 游走
- 响:\(\ce{H2}\) 放热会燃爆,发出嘶嘶响声
- 红:滴入酚酞,\(\ce{NaOH}\) 与酚酞变红
- \(\ce{Na}\) 与 \(\ce{HCl}\) 反应(与 \(\ce{NaOH + HCl \xlongequal{\quad} NaCl + H2O}\) 叠加)
\[\ce{2Na + 2HCl \xlongequal{\quad} 2NaCl + H2 ^}\]
- \(\ce{Na}\) 与 \(\ce{CuSO4}\) 反应(与 \(\ce{CuSO4 + 2NaOH \xlongequal{\quad} Cu(OH)2 + Na2SO4}\) 叠加)
\[\ce{2Na + 2H2O + CuSO4 \xlongequal{\quad} Cu(OH)2 v + Na2SO4 + H2 ^}\]
- 还原性(与 \(\ce{O2}\)、\(\ce{S}\)、\(\ce{Cl2}\)、\(\ce{H2}\) 等可以反应)
- 与 \(\ce{S}\) 反应
\[\ce{2Na + S \xlongequal{研磨爆炸} Na2S}\]
- 与 \(\ce{Cl2}\) 反应
\[\ce{2Na + Cl2 \xlongequal{点燃} 2NaCl}\]
- 与 \(\ce{H2}\) 反应
\[\ce{2Na + H2 \xlongequal{\triangle} 2NaH}\]
- \(\ce{NaH}\) 与 \(\ce{H2O}\) 反应
\[\ce{NaH + H2O \xlongequal{\quad} NaOH + H2 ^}\]
- 与 \(\ce{O2}\) 反应
- \(\ce{Na}\) 放置在室内中
\[\ce{\underset{银白}{Na} ->[O2] \underset{变暗}{Na2O} ->[H2O] \underset{吸潮}{NaOH} ->[CO2] \underset{白色固体}{Na2CO3}}\]
- \(\ce{Na}\) 与 \(\ce{O2}\) 点燃
\[\ce{2Na + O2 \xlongequal{点燃} Na2O2(淡黄色固体)}\]
- \(\ce{Na2O2}\) 由 \(\ce{Na+}\) 和 \(\ce{O2^{2-}}\) 组成
- \(\ce{Li+}\) 与 \(\ce{O^2-}\) 生成 \(\ce{Li2O}\),\(\ce{Na+}\) 与 \(\ce{O2^2-}\) 生成 \(\ce{Na2O2}\),\(\ce{Li+}\) 与 \(\ce{O2^-}\)(超氧根)生成 \(\ce{KO2}\)(半径依次增大)
二、氧化钠
1. 物理性质
1. 化学性质
- 与水反应呈碱性(碱性氧化物)
\[\ce{Na2O + H2O \xlongequal{\quad} 2NaOH}\]
三、过氧化钠
1. 物理性质
2. 化学性质
- 与水反应呈碱性,但不是碱性氧化物(碱性氧化物和水反应只生成碱,和酸反应只生成盐和水),同时也是歧化反应
\[\ce{Na2O2 + H2O \xlongequal{\quad} 4NaOH + O2 ^}\]
- \(\ce{Na2O2}\) 与 \(\ce{CO2}\) 反应(与 \(\ce{CO2 + 2NaOH \xlongequal{\quad} Na2CO3 + H2O}\) 叠加,可以发现 \(\ce{H2O}\) 是这个反应的催化剂,因为它先消耗后生成)
\[\ce{2Na2O2 + 2CO2 \xlongequal{\quad} 2Na2CO3 + O2 ^}\]
- \(\ce{Na2O2}\) 与 \(\ce{CuSO4}\) 反应(配平方法:把 \(\ce{Na2O2}\) 定 \(1\) 拆和)
\[\ce{2Na2O2 + 2Cu^2+ + 2H2O \xlongequal{\quad} 2Cu(OH)2 v + 4Na+ + O2 ^}\]
- \(\ce{Na2O2}\) 与 \(\ce{FeCl2}\) 反应(配平方法:把 \(\ce{2Na2O2 + 2Fe^2+ + 2H2O \xlongequal{\quad} 2Fe(OH)2 v + 4Na+ + O2 ^}\) 与 \(\ce{4Fe(OH)2 + O2 + 2H2O \xlongequal{\quad} 4Fe(OH)3}\) 叠加)
\[\ce{4Na2O2 + 4Fe^2+ + 6H2O \xlongequal{\quad} 4Fe(OH)3 v + 8Na+ + O2 ^}\]
- 氧化性与还原性
- \(\ce{Na2O2}\) 与 \(\ce{Na2SO3}\) 反应(主要体现氧化性)
\[\ce{Na2O2 + SO3^2- + H2O \xlongequal{\quad} SO4^2- + 2Na+ + 2OH-}\]
- \(\ce{Na2O2}\) 与酸性 \(\ce{KMnO4}\) 反应(遇到较强氧化剂,体现还原性)
\[\ce{2MnO4- + 5Na2O2 + 16H+ \xlongequal{\quad} 2Mn^2+ + 5O2 ^ + 10Na+ + 8H2O}\]
- 投入酚酞,先变红,后褪色
四、氢氧化钠、碳酸钠与碳酸氢钠
1. 物理性质与俗称
- \(\ce{NaOH}\) 俗称烧碱,\(\ce{Na2CO3}\) 俗称苏打、纯碱,\(\ce{NaHCO3}\) 俗称小苏打
- 溶解度 \(\ce{NaHCO3} < \ce{Na2CO3}\)
- \(\ce{NaOH}\) 易潮解吸湿
2. 化学性质
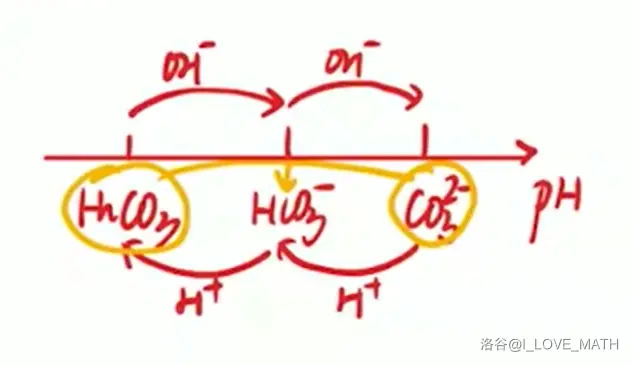
- \(\ce{CO2}\) 通入 \(\ce{Na2CO3}\)
\[\ce{CO2 + CO3^2- + H2O \xlongequal{\quad} 2HCO3-}\]
\(\ce{CO2}\) 通入饱和 \(\ce{Na2CO3}\)(溶解度 \(\ce{NaHCO3} < \ce{Na2CO3}\),所以有沉淀)
\[\ce{CO2 + CO3^2- + H2O + 2Na+ \xlongequal{\quad} 2NaHCO3 v}\]
- 向 \(\ce{Na2CO3}\) 中逐滴加 \(\ce{HCl}\)(现象:先无气泡,后产生气泡)
\[\ce{CO3^2- + H+ \xlongequal{\quad} HCO3-}\]
\[\ce{HCO3- + H+ \xlongequal{\quad} CO2 ^ + H2O}\]
- 向 \(\ce{HCl}\) 中逐滴加 \(\ce{Na2CO3}\)(现象:直接有气泡)
\[\ce{2H+ + CO3^2- \xlongequal{\quad} CO2 ^ + H2O}\]
- 鉴别 \(\ce{Na2CO3}\) 与 \(\ce{HCl}\) 只需互滴
- \(\ce{NaHCO3}\) 与 \(\ce{NaOH}\) 反应
\[\ce{NaHCO3 + NaOH \xlongequal{\quad} Na2CO3 + H2O}\]
- 反应图像
- 在一个有 \(\ce{NaHCO3}\)、\(\ce{Na2CO3}\)、\(\ce{NaOH}\) 的其中两种的溶液中逐滴加 \(\ce{HCl}\),三者碱性依次增大,反应顺序先和碱性强的反应
- \(\ce{NaOH}\) 与 \(\ce{Na2CO3}\) 混合滴 \(\ce{HCl}\)
\[\frac{n(\ce{NaOH})}{n(\ce{Na2CO3})} = \frac{a - (b - a)}{b - a}\]
- \(\ce{NaHCO3}\) 与 \(\ce{Na2CO3}\) 混合滴 \(\ce{HCl}\)
\[\frac{n(\ce{NaHCO3})}{n(\ce{Na2CO3})} = \frac{(b - a) - a}{a}\]
- 与 \(\ce{H2SO3}\) 的 \(N\) 形转换
\[酸性:\ce{H2SO3 > H2CO3 > HSO3- > HCO3-}\]
\[碱性:\ce{HSO3- < HCO3- < SO3^2- < CO3^2-}\]
- 少量 \(\ce{SO2}\) 通入 \(\ce{Na2CO3}\)
\[\ce{SO2 + H2O + 2CO3^2- \xlongequal{\quad} SO3^2- + 2HCO3-}\]
- 过量 \(\ce{SO2}\) 通入 \(\ce{Na2CO3}\)
\[\ce{2SO2 + H2O + CO3^2- \xlongequal{\quad} 2HSO3^- + CO2}\]
- 碳酸氢钠受热分解
\[\ce{2NaHCO3 \xlongequal{\triangle} Na2CO3 + CO2 ^ + H2O}\]
- \(a\,\mathrm{g}\) \(\ce{NaHCO3}\) 与 \(\ce{Na2CO3}\) 的混合物加热变为 \(b\,\mathrm{g}\),\(m(\ce{NaHCO3}) = \frac{a - b}{44 + 18} \times 2 \times 84\)
第十二章 铝及其化合物
一、氢氧化铝与铝盐
1. 物理性质
- 氢氧化铝是白色胶状沉淀,铝离子和四羟基合铝酸根离子都是无色离子
2. 化学性质
- 电离
\[\ce{Al(OH)3 Al^3+ + 3OH-}\quad 碱式电离\]
\[\ce{Al(OH)3 + H2O Al(OH)4- + H+}\quad 酸式电离\]
- 向 \(\ce{AlCl3}\) 中逐滴加入 \(\ce{NaOH}\)(现象:先生成白色沉淀,后白色沉淀溶解)
\[\ce{Al^3+ + 3OH- \xlongequal{\quad} Al(OH)3 v}\]
\[\ce{Al(OH)3 + OH- \xlongequal{\quad} Al(OH)4-}\]
- 向 \(\ce{NaOH}\) 中逐滴加入 \(\ce{AlCl3}\)(现象:先无沉淀,后生成白色沉淀)
\[\ce{Al^3+ + 4OH- \xlongequal{\quad} Al(OH)4-}\]
\[\ce{Al^3+ + 3Al(OH)4- \xlongequal{\quad} 4Al(OH)3 v}\]
- 向 \(\ce{AlCl3}\) 中滴加 \(\ce{NH3 * H2O}\) 或反滴(只发生此反应,\(\ce{NH3 * H2O}\) 为弱碱,\(\ce{Al(OH)3}\) 不溶于它)
\[\ce{Al3+ + 3NH3 * H2O \xlongequal{\quad} Al(OH)3 v + 3NH4+}\]
- 向 \(\ce{Na[Al(OH)4]}\) 中逐滴加 \(\ce{HCl}\)(现象:先生成沉淀,后沉淀消失)
\[\ce{Al(OH)4- + H+ \xlongequal{\quad} Al(OH)3 v + H2O}\]
\[\ce{Al(OH)3 + 3H+ \xlongequal{\quad} Al^3+ + 3H2O}\]
- 向 \(\ce{HCl}\) 中逐滴加 \(\ce{Na[Al(OH)4]}\)(现象:先无沉淀,后出现沉淀)
\[\ce{Al(OH)4- + 4H+ \xlongequal{\quad} Al^3+ + 3H2O}\]
\[\ce{Al^3+ + 3Al(OH)4- \xlongequal{\quad} 4Al(OH)3 v}\]
- 向 \(\ce{Na[Al(OH)4]}\) 中通 \(\ce{CO2}\)
\[\ce{2Al(OH)4- + CO2 \xlongequal{\quad} 2Al(OH)3 v + CO3^2- + H2O}\]
\[\ce{CO2 + CO3^2- + H2O \xlongequal{\quad} 2HCO3-}\]
- 离子反应顺序:中和反应 \(>\) 沉淀 \(>\) 溶液反应 \(>\) 沉淀溶解
- 向含 \(1\,\mathrm{mol}\,\ce{HCl}\)、\(1\,\mathrm{mol}\,\ce{AlCl3}\)、\(1\,\mathrm{mol}\,\ce{MgCl2}\)、\(1\,\mathrm{mol}\,\ce{NH4Cl}\) 的混合溶液中,逐滴加 \(\ce{NaOH}\)
\[1.\,\ce{H+ + OH- \xlongequal{\quad} H2O}\]
\[2.\,\ce{Al^3+ + 3OH- \xlongequal{\quad} Al(OH)3 v}\]
\[\quad\ce{Mg^2+ + 2OH- \xlongequal{\quad} Mg(OH)2 v}\]
\[3.\,\ce{NH4+ + OH- \xlongequal{\quad} NH3 * H2O}\]
\[4.\,\ce{Al(OH)3 + OH- \xlongequal{\quad} Al(OH)4-}\]
- 复杂图像:设少量为 \(1\)(因为少量一定会被反应完)
- \(\ce{Al2(SO4)3}\) 中滴加 \(\ce{Ba(OH)2}\)
\[\ce{3Ba^2+ + 6OH- + 3SO4^2- + 2Al^3+ \xlongequal{\quad} 2Al(OH)3 v + 3BaSO4 v}\]
\[\ce{Al(OH)3 + OH- \xlongequal{\quad} Al(OH)4-}\]
- \(\ce{NH4Al(SO4)2}\) 中滴加 \(\ce{Ba(OH)2}\)
\[\ce{Ba^2+ + 2OH- + 3SO4^2- + 2Al^3+ \xlongequal{\quad} 2Al(OH)3 v + 3BaSO4 v}\]
\[\ce{Ba^2+ + 2OH- + SO4^2- + 2NH4+ \xlongequal{\quad} BaSO4 v + 2NH3 * H2O}\]
\[\ce{OH- + Al(OH)3 \xlongequal{\quad} Al(OH)4-}\]
二、氧化铝
1. 物理性质
2. 化学性质
- 氢氧化铝的其他性质——受热分解
\[\ce{2Al(OH)3 \xlongequal{\triangle} Al2O3 + 3H2O}\]
- 氧化铝与酸、碱的反应
- 氧化铝的电离(氧化铝不溶于水,反应程度非常小,加酸或碱后反应正向移动)
\[\ce{Al2O3 + 3H2O 2Al(OH)3}\]
- 氧化铝与酸反应
\[\ce{Al2O3 + 6H+ \xlongequal{\quad} 2Al^3+ + 3H2O}\]
- 氧化铝与碱反应
\[\ce{Al2O3 + 2OH- + 3H2O \xlongequal{\quad} 2Al(OH)4-}\]
三、金属铝
1. 物理性质
银白色金属,粉末也为银白色
2.化学性质
- 与水、与酸、与碱的反应
- 与水反应(加酸、碱,平衡正向移动)
\[\ce{2Al + 6H2O \xlongequal{\quad} 2Al(OH)3 + 3H2 ^}\]
- 与酸反应
\[\ce{2Al + 6H+ \xlongequal{\quad} 2Al^3+ + 3H2 ^}\]
- 与碱反应(\(\ce{H2O}\) 为氧化剂,\(\ce{OH-}\) 只体现碱性)
\[\ce{2Al + 2OH- + 3H2O \xlongequal{\quad} 2Al(OH)4- + 3H2 ^}\]
- 还原性
- 与 \(\ce{O2}\)、\(\ce{Cl2}\)、\(\ce{S}\) 等反应(\(\ce{Al2S3}\) 与水反应生成 \(\ce{Al(OH)3}\)、\(\ce{H2S}\))
\[\ce{4Al + 3O2 \xlongequal{\quad} 2AlO3}\]
\[\ce{4Al + 3Cl2 \xlongequal{点燃} 2AlCl3}\]
\[\ce{2Al + 3S \xlongequal{\triangle} Al2S3}\]
- 铝热反应(\(\ce{Al}\) 与 \(\ce{Fe2O3}\) 为铝热剂)
\[\ce{2Al + Fe2O3 \xlongequal{高温} Al2O3 + 2Fe}\]
- 与氧化性酸反应(常温钝化,需加热)
\[\ce{2Al + 6H2SO4(浓) \xlongequal{\quad} Al2(SO4)3 + 3SO2 ^ + 6H2O}\]
\[\ce{Al + 6HNO3(浓) \xlongequal{\quad} Al(NO3)3 + 3NO2 ^ + 3H2O}\]
来源:程序园用户自行投稿发布,如果侵权,请联系站长删除
免责声明:如果侵犯了您的权益,请联系站长,我们会及时删除侵权内容,谢谢合作! |